现代细胞生物学上的发现都需要借助于全面的、多种的检测手段来满足全新研究方向的需求,每次研究手段发展与进步,所促进获得的成就都会令人无比兴奋。
细胞信号通路概念由在上世纪 80 年代被提出,目前解释是能将细胞外的分子信号经细胞膜传入细胞内发挥效应的一系列酶促(磷酸化、泛素化等)反应通路,通过反应改变通路中蛋白的构像。通常情况下如果是胆固醇等脂质的话,可直接穿通细胞磷脂双分子层进入细胞进行结合。如果信号分子是多肽的话,如常见的是生长因子、细胞因子、激素、神经递质以及其它小分子化合物等,只能先于细胞外的受体蛋白结合(受体通常为跨膜蛋白),细胞外的信号分子称为配体,可以由一种信号分子引起下游信号级联放大,也可以由不同信号分子以组合方式进行信号放大调节。
NF-κB 由诺贝尔奖获得者 David Baltimore 于 1986 年发现(图 1),从 B 淋巴细胞的细胞核抽提物中找到的转录因子,NF 是核因子,κB 是因为它能与免疫球蛋白 kappa 轻链基因的增强子 B 序列特异性结合,促进 κ 轻链基因表达,因此得名,其本身是一种蛋白质复合物,能够控制转录的 DNA、细胞因子的产生和细胞存活[1]。

针对其研究历史久远,在细胞信号通路领域中具有举足轻重的地位。众所周知,其参与细胞对刺激的反应,如自由基,重金属,紫外线照射,氧化 LDL 以及细菌或病毒抗原,如果出现调节异常,会引起炎症反应、自身免疫疾病,感染性休克、细胞增殖、分化以及凋亡的紊乱。目前大家熟知其在天然免疫机制中发挥着非常重要的作用,也有很多文章研究发现 NF-κB 是炎症和癌症之间的重要纽带,最近的一篇文章研究发现,酒精和其他滥用药物可诱导大脑中的 NF-kB 活性和细胞因子表达,认为 NF-kB 和酒精以及药物成瘾之间可能存在联系[2]。
通常情况下, 在细胞质中的 NF-κB 处于失活状态,它的二聚体形式的复合物能与一个抑制蛋白 IkB(inhibitory protein of NF-κB)结合成一个全新的三聚体复合物。三聚体形式下, NF-κB 被 IkB 抑制而没有活性。NF-κB 通路的主要上游激活信号因子是 TNF(肿瘤坏死因子),当然还有其他很多因子可以激活这个通路,如 IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX2、趋化因子、粘附分子、集落刺激因子等。
以 TNF 为例,它有两个亚型,分别是 TNF-α 与 TNF-β。当与细胞膜表面的 TNF 受体结合后,受体发生构象改变并且与胞内的下游分子发生相互作用,招募蛋白将信号传递给 IKK(IkB kinase)激酶,其能使 IkB 蛋白磷酸化,导致NF-κB从三聚体中解离出来,NF-κB 的二聚体迅速从细胞质进入细胞核内,与核内 DNA 上的特异序列相结合,促进相关基因的转录(图 2) [3]。
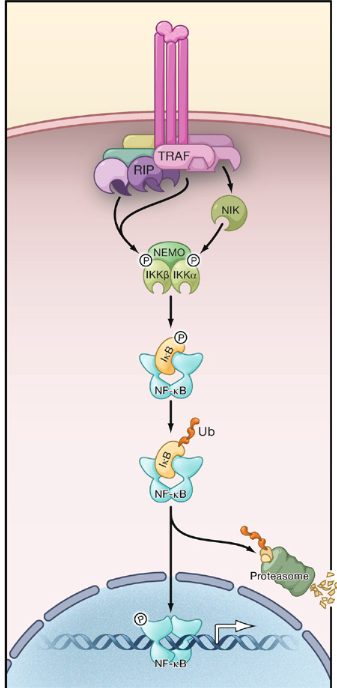
图 2:在受体蛋白复合物,IKK 信号通过 TRAF/RIP 复合物传递,通常与 TAK1 结合,导致典型的 NF-κB,IKK 激活导致 IκB 磷酸化的经典路径或 p100 处理 p52 的非经典里的途径。
有些文章研究发现新的机制调节 NF-κB,即分子机制中通过泛素化调节, 包括参与多个泛素连接,诱导的 NF-κB 激活那些刺激(IL - 1)及肿瘤坏死因子 -α(TNFα)与相应受体结合后,触发不同信号级联的激活,这些信号级联汇聚于 TAK1[4],与磷酸化、乙酰化等修饰相比,泛素化修饰更为复杂。
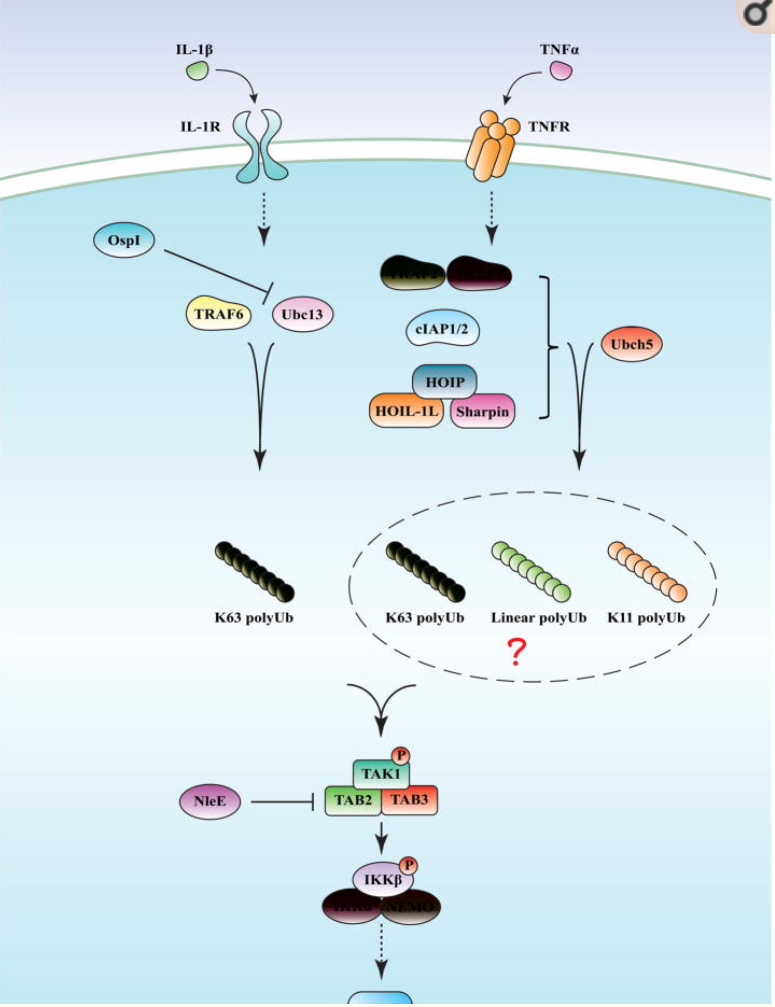
图 3:IL-1 诱导因子刺激细胞导致泛素 E3 连接酶 TRAF6 的激活,催化合成与 TAK1 激酶复合物 TAB2 亚基结合的 K63 多聚泛素链,导致 TAK1 激活,TAK1 然后磷酸化 IKKβ, NF-κB 激活。TNF 细胞通路中,细胞的刺激导致招募到受体上的几个泛素 E3 连接酶,E3 和 Ubch5 合成不同连接的泛素链,包括 K63、K11 等泛素链,目前靶点机制尚不清楚,可以肯定的是泛素化事件导致了 TAK1 和 IKK 的激活。
目前针对细胞的 NF-κB 信号通路检测方法很多,如 EMSA、Western Blot、PCR、ELISA、报告基因系统分析检测及免疫组化来检测其表达含量,此外还有其他的方法如基于 GFP 报告基因的高内涵筛选检测系统等。由于 NF-κB 是转录因子,它的活性主要体现在两个方面,DNA 结合活性和反式激活活性,检测其结合活性最经典的方法是 EMSA,NF-kB 的报道基因分析 NF-kB 的反式激活能力较为理想手段。
1、EMSA
EMSA 是凝聚迁移滞留实验(基于核酸与蛋白质复合体在聚丙烯酰胺凝胶电泳不同迁移率原理),目前是应用于检测 NF-κB 与 DNA 结合活性、是最经典的 NF-κB 检测方法。原理是带标记(放射性同位素 P 或生物素标记)物与 NF-κB 有共有序列的寡核苷酸探针结合到 NF-κB 后,其分子量和表面电荷发生改变,非变性条件下电泳,其泳动率比未结合的游离探针慢,经过自显影后(放射性标记)检测其活性,结合凝胶图像分析,可实现定量。放射性标记物虽然灵敏度高,但是存在污染因素,非放射性方法通常采用生物发光原理进行检测,灵敏度与放射性方法相近。
2、ELISA
此种检测方法基于经典的 ELISA 方法(酶联免疫吸附试验),可以定量检测转录因子活动的一种经济、简便、快捷方式,原理是首先将含有NF-κB结合位点的特定双链DNA序列(5’- GGGACTTTCC - 3’)包被于 96 孔板上,核提取物中的活性 NF-κB 特异性地与包被于 96 孔板上的寡核苷酸结合,一抗可识别 p50、p52、p65、c-Rel 或 RelB 上的一个表位,HRP 标记特异性二抗与一抗结合,加入底物显色后,使用 SpectraMax ABS plus 微孔板读板机获得 450nm 的 OD 值,如下图所示;
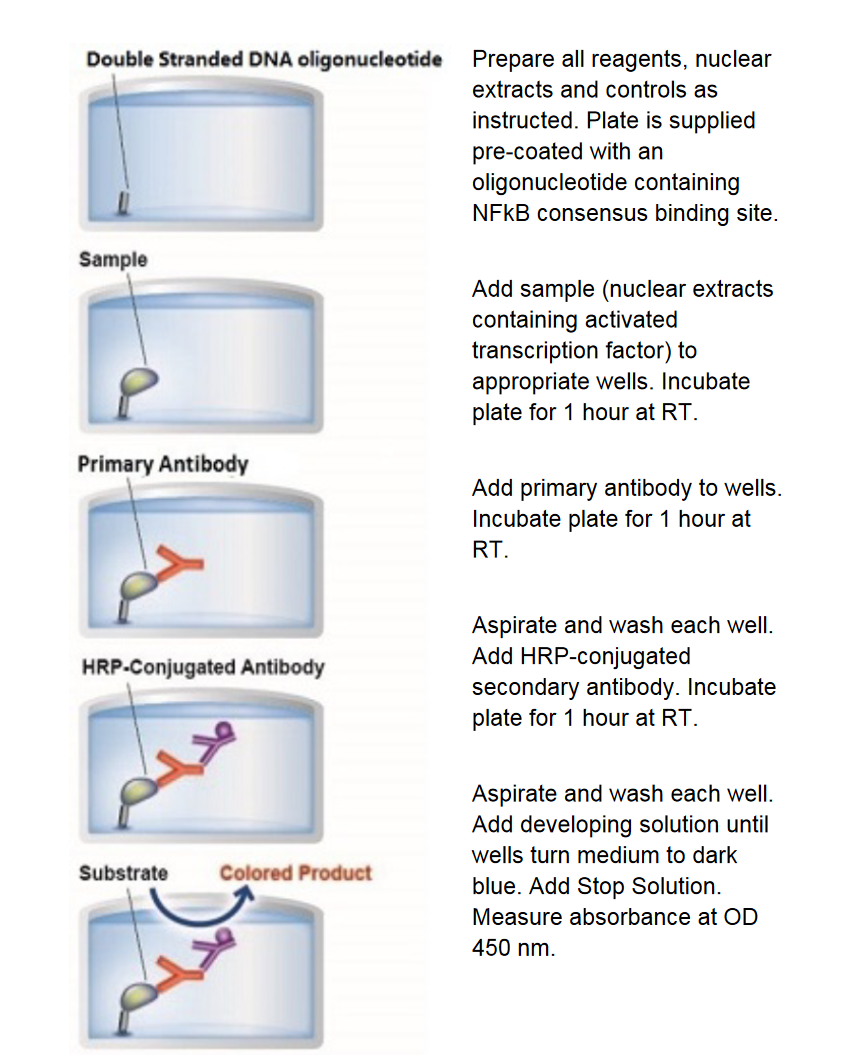

图 4:ELISA 检测细胞内 NF-κB 流程示意图
3、Western Blot
通常情况下,我们经常用 Western Blot 方法针对 NF-κB 通路进行检测,一是直接检测 NF-κB 表达含量,正常情况下 NF-κB 存在一定表达含量,在相应信号因子刺激下,NF-κB 表达含量发生异常改变,我们可以只利用 Western Blot 方法获得 NF-κB 蛋白表达含量变化情况,其二是通过检测细胞质的 IκB 的降解,信号通路打开,刺激 NF-κB 与 IκB 分离,NF-κB 进入细胞核启动 DNA 合成,IκB 则被降解。这种方法具有经济简便、耗时少、操作简单等优势,是最常用的方法。但是因为并不是 NF-κB 复合蛋白核转运了后就一定能参与基因调控,所以你做 Western Blot 仅仅可以获得核转运的 NF-κB 蛋白含量,不能直接反应出 NF-κB 的活性。
Molecular Devices 公司的 SpectraMax i3x\iD5 多功能微孔板读板机组合 ScanLater Western Blot 检测模块,采用基于时间分辨荧光染料标记二抗进行膜上蛋白分析,具有操作简便、分析结果灵敏度高、稳定性好等优点,图 5 所 示。
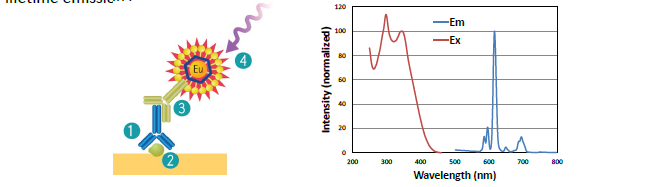
图 5:左侧,ScanLater Western Blot 系统工作流程(1)一抗结合感兴趣目标蛋白;(2)铕元素标记二抗与特异性结合一抗结合;(3)放入微孔板检测系统进行信号扫描检测;右侧,铕元素激发光谱与发射光谱位置,无交叉干扰因素优势;
4、报告基因
报告基因对于基因表达的研究是非常有用的工具之一,可以替代要研究的目的基因,从而帮助我们了解目的基因的信号通路和相关疾病,如 GFP、ß- 半乳糖苷酶和双荧光素酶报告基因体系,我们介绍如何利用具有化学发光的微孔板读板机 SpectraMax iD5 对双荧光信号进行检测,并归一化检测信号,优化实验条件等。NF-kB 的报告基因分析 NF-kB 的反式激活能力,活化的 NF-kB 可以结合在荧光素酶的 promoter 区,启动报告基因转录,通过检测报告基因活性间接反应 NF-kB 的活性,图 6 所示;
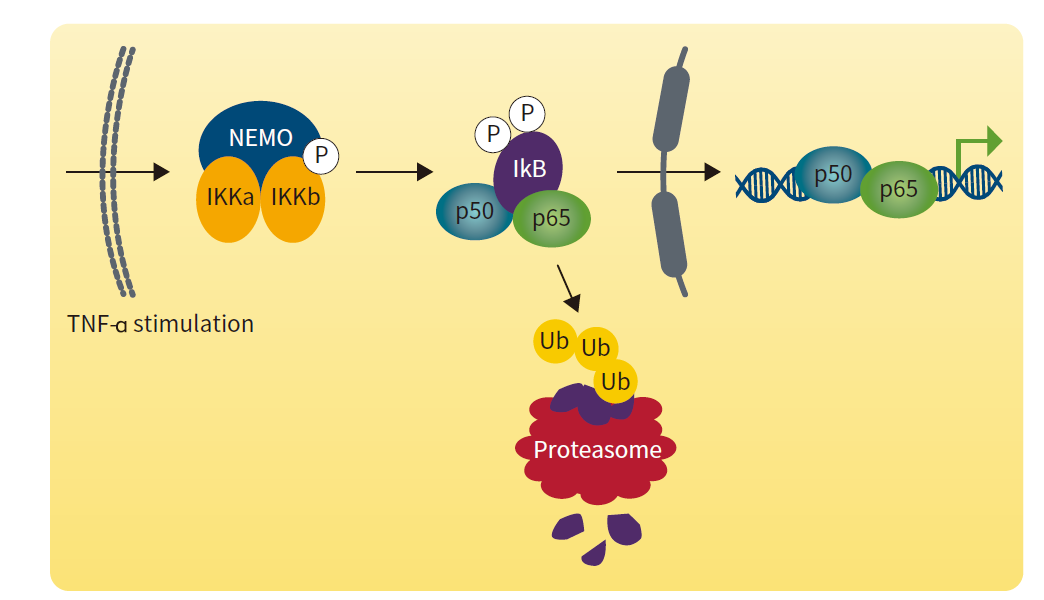
图 6:TNF-α 激活信号层级反应使 NF-κB 抑制剂 IKB 降解,并释放 NF-κB 转录因子
将 10 μg/mL TNF-α 的溶液用细胞培养基稀释到 20ng/ml 制成诱导溶液。无添加培养基作为对照。这里我们探索使用不同体积转染试剂于不同含量 DNA 的比例关系,发现相对于诱导条件的变化而言,各种转染条件均能检测到海肾荧光素酶的高表达,而加入细胞因子 TNF-α 会大大增加萤火虫荧光素酶的表达水平图 7 所示。总之,转染试剂与 DNA 比例为 2:1 时荧光素酶的表达水平较其他比例而言最低。
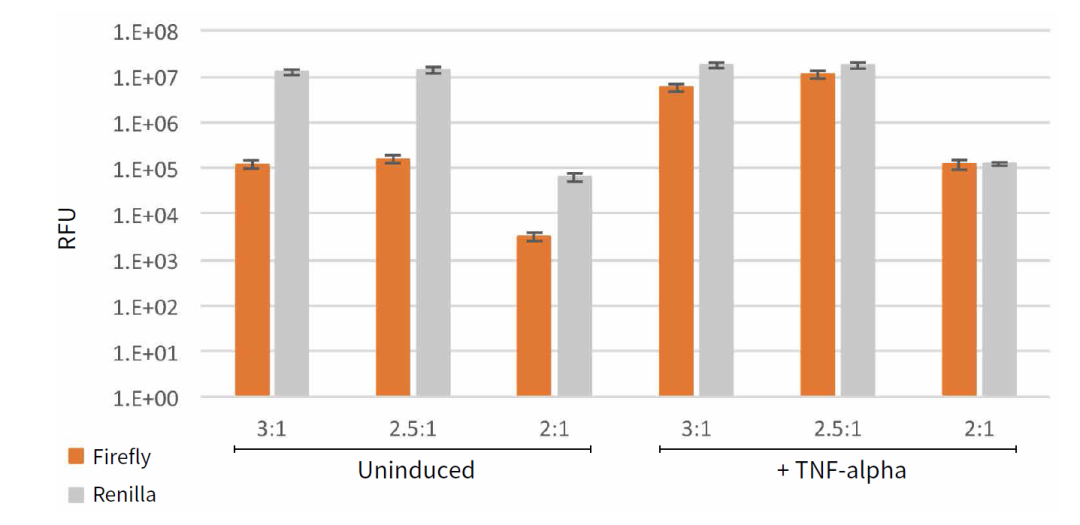
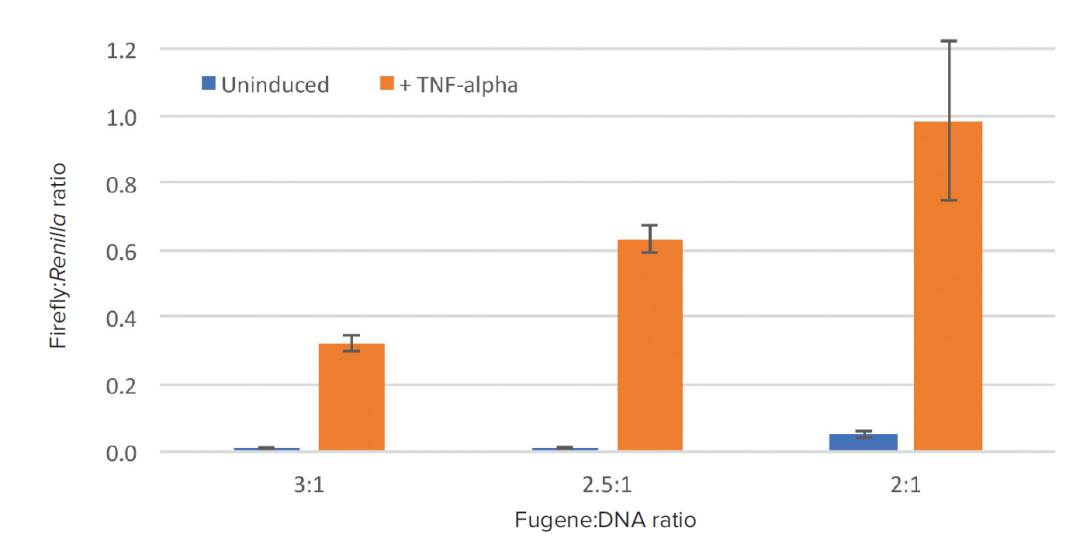
图 7:所示为不同转染条件下(转染试剂:DNA 比值)TNF-α 未诱导和诱导的 RFU 值。每个转染条件有 9 个重复,用海肾发光值对萤火虫 RLU 做均一,发现 2:1 比例最佳。
参考文献
[1] Sen R, Baltimore D. Inducibility of kappa immunoglobulin enhancer-binding protein Nf-kappa B by a posttranslational mechanism. Cell.1986, 26;47(6):921-8
[2] S.E. Nennig and J.R. Schank. The Role of NFkB in Drug Addiction: Beyond Inflammation, Alcohol and Alcoholism, 2017, 52(2) 172–179
[3] Hayden MS, Ghosh S (2008) Shared principles in NF-kappaB signaling. Cell 132(3), 344–62
[4]Chen J, Chen ZJ (2013) Regulation of NF-κB by ubiquitination. Curr. Opin. Immunol. 25(1), 4–12